东波教授论文(GLP1R-GFP稳定转染 Rin-m5F 细胞系的构建)
9月6日,首个国家亚健康干预技术成果应用中心落户长沙麓谷,国家中医药管理局亚健康干预技术实验室隶属于国家中医药管理局,是国内唯一从事亚健康干预技术研究的专业机构,拥有以国家973项目主持人、教育部新世纪优秀人才为核心的研究团队,专业从事亚健康干预技术的研究。2012年9月,该实验室主任刘东波教授当选为联合国亚太亚健康干预技术联盟主席,以“未病防病、既病防变、愈后防复”为目标,对慢性非传染性疾病提出心理、行为、膳食和营养干预方案,并于2016年成立了国家中医药管理局亚健康干预技术实验室糖尿病干预中心。糖尿病作为实验室创立后的一个重要的慢性病研究对象,历经长期研究,独创了国内第一套糖尿病中医营养干预技术。
刘东波教授文献当中分享了国家中医药管理局亚健康干预技术实验室糖尿病干预中心研究成果。他指出,糖尿病中医营养干预技术就是以三低三高(低血糖负荷、低卡路里、低碳水化合物和高不饱和脂肪酸、高膳食纤维、高药食同源)的饮食模式和间歇性禁食方式治疗糖尿病,以科学的方法为导向,重点教会糖尿病病人正确的健康生活方式,教会他们自我管理血糖的方法,逐步实现恢复胰岛功能,重新夺回控制血糖的主动权,帮助广大糖尿病患者控制病情发展的问题,有利于糖尿病患者科学的自我管理,达到改善健康状况或治疗疾病的目标。
以下是刘东波教授的文献:
GLP1R-GFP稳定转染 Rin-m5F 细胞系的构建
胡涌泉 1,2 ,曾璐漫 2,6 ,吴艳阳 2,5 ,魏云林 7 ,刘东波 1,2,3,4*
(1. 湖南农业大学园艺园林学院,长沙 410128;2. 国家中医药管理局亚健康干预技术实验室,长沙 410128;3. 湖南省作物种质创新与资源利用重点实验室,长沙 410128;4.湖南省植物功能成分利用协同创新中心,长沙410128;5. 湖南农业大学食品科学技术学院,长沙 410128;6. 湖南应用技术学院,湖南 常德415100;7. 昆明理工大学生命科学与技术学院,昆明 650500)摘要:目的 本研究目的是构建一种能稳定表达绿色荧光蛋白(GFP)人胰高血糖素样肽 -1 受体(GLP1R)的胰岛细胞系,用来筛选 GLP1R 激动剂类药物。方法 使用 X-tremeGENE HP DNATransfection Reagent将 pCMV6-AC-GLP1R-GFP 质粒转染到 Rin-m5F细胞,经 G418 筛选单克隆 Rin-m5F/GLP1R-GFP 细胞并扩大培养。结果 该细胞能稳定传代,荧光显微镜下观察细胞绿色荧光分布均匀,Western blot验证 GLP1R 蛋白表达显著增加。在实验验证中,对照空白组中细胞绿色荧光分布均匀,阴性药物格列本脲(非 GLP1R 靶点药物)作用时细胞内无明显荧光斑点出现,阳性药物百泌达作用(GLP1R 激动剂类药物)时细胞内出现显著荧光斑点。结论 GLP1R 激动剂类药物筛选模型 Rin-m5F/GLP1R-GFP 成功构建。该模型能对混合物样品进行筛选,具有假阳性极低、筛选所需样本小、筛选样品量大、易标准化、筛选速度快、特异性强等优势,为 GLP1R 激动剂类药物的筛选奠定了基础。
关键词:人胰高血糖素样肽 -1 受体;Rin-m5F;质粒转染
中图分类号:R739.4 文献标识码:A 文章编号: 1672-2981(2017)06-0785-05doi:10.7539/j.issn.1672-2981.2017.06.018Construction of GLP1R-GFP stably transfection Rin-m5F cell linesHU Yong-quan 1, 2 , ZENG Lu-man 2, 6 , WU Yan-yang 2, 5 , WEI Yun-lin 7 , LIU Dong-bo 1, 2, 3, 4* (1. Horticulture andLandscape College, Hunan Agricultural University, Changsha 410128; 2.State Key Laboratory of SubhealthIntervention Technology, Changsha410128; 3. Hunan Key Laboratory of Crop Germplasm Innovation andUtilization, Hunan Agricultural University, Changsha 410128; 4. Hunan Co-Innovation Center forUtilizationof Botanical Functional Ingredients, Changsha 410128; 5. College of Food Science and Technology, HunanAgricultural University, Changsha 410128; 6. Hunan College of Applied Technology, Changde Hunan 415100;7. Faculty of Life Sciences and Technology, Kunming University of Science and Technology, Kunming 650500)Abstract: Objective To establish a new method to screen glucagon like peptide-1 receptor (GLP1R) agonists.Methods The pCMV6-AC-GLP1R-GFP plasmid was transfected into Rin-m5F cells byX-tremeGENE HPDNA transfection reagent. Monoclonal Rin-m5F/GLP1R-GFP cells were screened by G418. The fluorescencespots were observed by fluorescence microscope. GLP1R expression was de tected by Western blot. ResultsThese cells were passaged normally with stable green fluorescence, and the expression of GLP1R protein wassignificantly increased. The green fluorescence of the control group was dispersive, and the Glibenclamide
(non GLP1R target drugs) treatment group did not show distinct fluorescence spots, while the Byetta (GLP1Ragonists) treatment group showed lots of fluorescence spots (activation of GLP1R). Conclusion Rin-m5F/GL-P1R-GFP, the model for GLP1R agonist screening, has been successfully constructed. This model is rapid and基金项目:国际科技合作与交流专项(No.2013DFG32060)。
作者简介 :胡涌泉,男,在读硕士研究生,主要从事细胞生物学、分子营养研究,E-mail:bookhulai@sina.cn * 通讯作者:刘东波,男,教授,博士研究生导师,主要从事亚健康干预基础和应用技术研究,Tel:(073184617244,E-mail:chinasaga@163.com786Central South Pharmacy. June 2017, Vol. 15 No.6 中南药学 2017 年 6 月 第 15 卷 第 6 期糖尿病是由遗传因素、病毒感染、自由基毒素、细胞因子等各种致病因子作用于机体导致胰岛功能减退,肝脏、骨骼肌、脂肪组织等发生胰岛素抵抗进而引发的一系列代谢紊乱综合征[1-4] 。临床上以高血糖(空腹血糖> 7.0 mmol·L- 1 ,餐后血糖> 11.1mmol·L- 1 )为主要特点 [5] 。糖尿病患者组织器官长期处于高血糖状态会引发诸多并发症,导致心脑血管、肝、肾眼、足等部位的衰竭病变,且无法治愈[6-8] 。胰 高 血 糖 素 样 肽 1(GLP1) 因 与 GLP1 受 体(GLP1R)结合后可刺激胰岛素分泌并抑制胰高血糖素分泌,已成为近些年糖尿病药物开发的重要靶点[9] 。已有的 GLPlR 激动剂类药物均属于大分子多肽类,不能口服给药,长期服用会产生诸多不良反应,且保存与运输条件要求严苛[10-11] 。因此需要寻找不良反应少且疗效长期稳定的 GLP1R 小分子激动剂药物。目前基于 GLPlR 为靶点构建的高通量 GLP1 激动剂筛选模型主要从受体与配体结合、检测胞内第二信使 cAMP、构建受体功能反应报告基因三个方面进行[12] 。但这些筛选模式假阳性高、筛选时间长、筛选效低,严重制约了 GLP1 类似物小分子药物的开发。因此建立筛选 GLPlR 激动剂模的研究变得尤为迫切。本文研究目的是建立一种新的 GLPlR 激动剂类药物筛选方法:构建稳定表达绿色荧光蛋白人 GLP1R 细胞模型 Rin-m5F/GLP1R-GFP并通过阳性药物百泌达、阴性药物格列本脲验证该模型应用于 GLPlR 激动剂类物筛选的效果。
1 材料
1.1 细胞
株大鼠胰岛素瘤细胞株(Rin-m5F)(上海通派生物科技有限公司)。
1.2 试药
pCMV6-AC-GLP1R-GFP 质粒(湖南农业大学刘东波教授惠赠),RMPI 1640 培养基(Gibco),胎牛血清(BI),谷氨酰胺(TransGen),0.25%EDTA- 胰酶(TransGen),X-tremeGENE HP DNA TransfectionReagent(Roche)G418(Sigma),防荧光淬灭封片剂(Southern Biotech),多聚甲醛(Sigma),GLP1R抗体(Abcam),GAPDH 抗体(Yataihengxin),羊抗小鼠 IgG1 二抗(Southern Biotech),羊抗兔 IgG1 二抗,一次性过滤器(Millex),一次性注射器(上海治宇),圆形盖玻片、载玻片(世泰),细胞培养板(Corning)等。
1.3 仪器
CO 2 恒温细胞培养箱(美国 SHELLAB),倒置显
微镜(上海荼明光学 BXP-106),倒置荧光显微镜(日本 OLYMPUS),激光共聚焦荧光显微镜(Zeiss LSM710),超净工作台(苏州净化设备有限公司,SW-CJ-IFD),Countess 自动细胞计数仪(Life Technologies),电子天平(型号 JL3003,JENNER),超纯水仪(Milli-RO Plus,millipore)等。
2、方法
2.1 细胞培养
细胞复苏后置于 25 cm 2 培养瓶中,在 37℃,5%CO 2 条件下培养,具体方法见参考文献[13] 。
2.2 转染及其体系优化
① 取对数生长期 Rin-m5F细胞消化成单个的细
胞悬液,均匀接种于 6 孔板中,设置细胞密度分别为2×10 5 、4×10 5 个·mL- 1 ,CO2 培养箱过夜培养;
②根据转染试剂说明书上推荐的使用浓度制备转染溶液,质粒(μg)∶转染试剂(μL)分别为 1∶2、1∶3、1∶4。取 2.5 μg pCMV6-AC-GLP1R-GFP 质 粒 溶 于 97 μL无血清 RMPI 1640 培养基中,轻轻来回混匀,室温静置5 min,使质粒与培养基充分混匀;再按照比例相应加入转染试剂,轻轻来回混匀,室温静置 40 min,使混合物充分混匀;
③ 弃掉 6 孔板中的培养基,用 PBS 洗2 遍,每孔加入 2 mL新鲜完全培养基;
④ 在转染组逐滴加入转染溶液,边加边晃动 6 孔板,使转染液与细胞培养基充分混匀。
⑤ 标记好空白组及对照组,将细胞放入 CO 2 细胞培养箱中,37℃、5%CO 2 培养24 h;
⑥倒置荧光显微镜下观察,随机选取视野并拍照。运用软件 Image-Pro-Plus 6.0 统计细胞数目,计算转染效率;
⑦ 去掉转染溶液,PBS 洗 2 遍,加入新鲜完全培养基恢复培养 2 d,备用。
2.3 优化 G418 筛选浓度
① 取对数生长期 Rin-m5F细胞消化成单个的细胞悬液,均匀接种于 24 孔板中,过夜培养。
② PBS 洗2 遍,更换新鲜培养基,按下面浓度加入 G418 溶液:1000、600、200、100、50、0 μg·mL -1 。
③ 按照步骤②中 G418 浓度梯度,每 2 日更换 1 次新鲜培养基(含 G418),连续培养观察 14 d。若孔内细胞大量死亡,则该孔 G418 减半筛选;若孔内细胞已全部死亡,则该孔停止加入 G418 溶液。每日在倒置显微镜下观察细胞死亡情况。
④ 将“2.2”项下恢复培养 2 d 后转染组的细胞,加入 1 mg·mL -1 G418 溶液培养 2 d,PBS 洗 2 遍,更换新鲜培养基继续培养,每日观察细胞生长情况。
2.4 筛选单克隆细胞株
① 按照“2.2”项下最佳转染体系转染细胞,24 hefficient for screening GLP1R agonists, owint to its advantage of admixture-screening, high throughput, lowfalse positive rate, fewer samples needed and ease of application comparing to the traditional screening model.Key words: glucagon like peptide-1 receptor; Rin-m5F; plasmid transfection787
中南药学 2017 年 6 月 第 15 卷 第 6 期 Central South Pharmacy. June 2017, Vol. 15 No.6后去转染液,PBS 洗 2 遍,更新 2 mL新鲜培养基,37℃、5%CO 2 恢复培养 2 d。
② 加入 G418,筛选转染细胞。按“2.3”项下筛选得到的 G418 浓度,先选用使细胞大量死亡的浓度,然后更换小浓度 G418 继续筛选。
③ 每日在倒置荧光显微镜下观察,当转染组中未被转染的细胞全部被杀死,则停止 G418 筛选。
④PBS 洗 2 遍,更换新鲜培养基,37℃、5%CO 2 培养,至绿色荧光细胞出现单克隆团细胞。期间根据培养基颜色及细胞状态及时更换新鲜完全培养基。
⑤ 采用梯度稀释法筛选单克隆细胞株:将转染组中孔内的细胞用胰酶消化,弃掉胰酶,加入 1 mL新鲜完全培养基将细胞吹打成单个的细胞悬液。按照 10 倍稀释法,将细胞加入 96 孔板中依次进行稀释,直至孔内细胞浓度为 1 ~ 2 个每 100 μL。
⑥ 每日置于倒置荧光显微镜下观察,根据实际情况为细胞更换新鲜完全培养基。
⑦当 96 孔板内细胞密度达到 30%时,消化细胞移入 24孔内扩大培养。
⑧ 当 24 孔板内细胞密度达到 80%以上时,消化细胞移入 T-25 细胞培养瓶中扩大培养。
⑨冻存细胞,备用。
2.5 Western blot检验
在 6 孔板内分别接种相同数目的 Rin-m5F野生型细胞和步骤“2.4”项下获得的Rin-m5F/GLP1R-GFP单克隆细胞株,在完全培养液中培养至细胞密度长至90%左右。PBS 洗 2 遍,每孔加 200 μL2%SDS 裂解液,收取蛋白样品。置于 100℃水浴 10 min,加入 40μL的 6× 上样 Buffer稀释,置于 100℃水浴 10 min。Western blot实验方法见参考文献[14] 。
2.6 模型验证
实验分为空白对照(完全培养基)、溶剂对照(培养基加入 1%PBS、1%酒精、1%DMSO)、阳性对照(GLP1R 靶点药剂,百泌达)、阴性对照(非 GLP1R靶点药剂,格列本脲)。不同浓度药物处理相同时间:浓度设置为 0.25、0.5、2.5、5 μg·mL- 1 ,均处理 1 h。相同浓度药物处理不同时间:药物浓度为 0.25μg·mL- 1 ,分别处理 10、20、40、120 min。
操作流程:
① 将无菌圆形玻片在酒精灯火焰上来回灼烧数次,冷却后平铺在 24 孔板内,每孔一片;
②取“2.4”项下获得的单克隆细胞 Rin-m5F/GLP1R-GFP接种于圆形玻片上,轻轻摇晃培养板,使细胞均匀分布在板内,过夜至细胞密度长至 85%以上;
③ PBS 洗2 遍,加入含不同浓度药物的培养基 37℃孵育不同时间;
④ 吸弃培养液,PBS 洗 3 遍。加入 500 μL 4%多聚甲醛固定细胞 10 min,吸弃,PBS 洗 3 遍;
⑤ 取洁净载玻片,滴加 20 μL防荧光淬灭粘片剂,用镊子轻轻夹起圆形玻片,轻轻倒扣在防荧光淬灭粘片剂上,防止气泡产生;
⑥ 将玻片置于暗室通风干燥过夜,制好的玻片于激光共聚焦荧光显微镜下观察并拍照。
2.7 数据统计与分析
采用 SPSS 17.0 软件进行统计学分析。数据以均数 ± 标准差(x±s)表示,组间采用单因素方差分析,各组均数都采用 LSD(Least-significant differencetest)检测,若 P < 0.05 为差异有统计学意义。
3、结果
3.1 细胞形态观察
细胞 Rin-m5F复苏时在显微镜下观察,细胞基本呈单个、圆形均匀分布在新鲜完全培养基内,细胞密度为 50%左右,培养基中无明显杂质。过夜培养后,细胞贴壁率为 90%以上,细胞轮廓清晰、多呈不规则形状分布,多呈岛状聚集铺开生长。经胰酶消化,显微镜下观察显示细胞逐渐变圆,细胞间开始出现间隙。吹打成单个以 1∶3 传代至 3 代时,细胞形态正常、生长速率恢复到最佳,每 2 ~ 3 日即可传代(见图 1)。
图 1 Rin-m5F细胞显微镜观察图(200×)
Fig 1 Micro-observation of Rin-m5F cell lines(200×)
3.2 转染及其体系优化
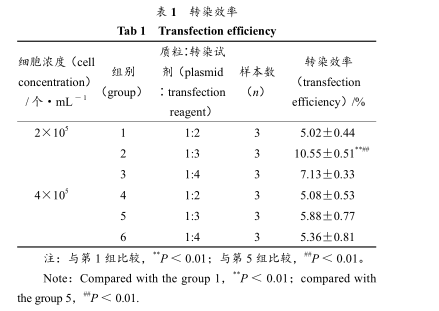
转染时在细胞接种量、质粒∶转染试剂 2 个方面进行优化,转染 24 h 后,倒置荧光显微镜下观察转染成功的细胞整个分布绿色荧光、荧光强度不一。拍照、统计转染效率分别见表 1。
表 1 转染效率Tab 1 Transfection efficiency
3.3 选择合适的 G418 筛选浓度
加入各浓度 G418 培养细胞,每日在倒置显微镜下观察细胞生长状态。观察得到 10 ~ 14 d 最低浓度至全部细胞死亡的 G418 浓度为 100 μg·mL -1 。但是Rin-m5F细胞在 G418 作用 48 h 后,浓度 1 mg·mL -1组的细胞基本全部死亡。Rin-m5F细胞转染组在 1788Central South Pharmacy. June 2017, Vol. 15No.6 中南药学 2017 年 6 月 第 15 卷 第 6 期mg·mL -1 G418 中培养 48 h 后,未转染的细胞大量死亡,转染成功带绿色荧光的细胞形态无显著变化,继续培养,带绿色荧光的细胞开始分裂增殖(见图 2)。

图 2 荧光显微镜细胞观察图(scale bar= 100 μm)
Fig 2 Fluorescence microscope-observation ofcells(scale bar = 100μm)
3.4 筛选单克隆细胞株
Rin-m5F细胞孵育转染溶液 24 h、更换新鲜完全培养基恢复培养 24 h、1 mg·mL -1 浓度的 G418 筛选培养 2 d 后,倒置荧光显微镜下观察未被转染的细胞基本全部死亡。降低 G418 浓度至 100 μg·mL -1 ,每3 日更换 1 次新鲜完全培养基,成功转染的细胞扩大培养 12 d,按照 10 倍稀释法消化细胞接种于 96 孔板,选取荧光强、分布均匀的单克隆细胞并扩大培养,倒置荧光显微镜和激光共聚焦显微镜下观察、拍照,结果见图 3。
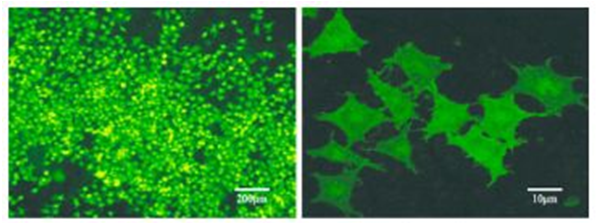
图 3 Rin-m5F/ GLP1RGFP 单 克 隆 细 胞 观 察 图(scale bar= 200μm、10 μm)
Fig 3 Observation ofRin-m5F/ GLP1R-GFP monoclonal cells(scalebar= 200 μm、10 μm)
3.5 蛋白印记鉴定
以 Rin-m5F为空白对照,53 KD 处转染后获得的单克隆细胞株 Rin-m5F/GLP1R- GFP 中 GLP1R 表达量增加,结果见图 4。结果表明:GLP1R 已成功转染,并在单克隆细胞中稳定表达。
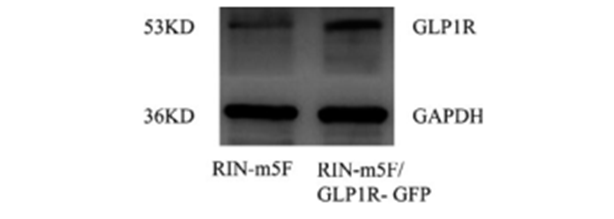
图 4 GLP1R 的表达
Fig 4 Expression of GLP1R
3.6 模型验证
单克隆细胞株 Rin-m5F/GLP1R-GFP 在不同条件下孵育,收样、制片,置于激光共聚焦下观察并拍照,结果见图 5 ~ 6。如图所见,溶剂对照组中细胞绿色荧光均匀分布,阴性对照组(非 GLPlR 靶点药物)中无明显荧光斑点,阳性对照组(GLPlR 激动剂药物)中细胞内出现明显的荧光斑点。
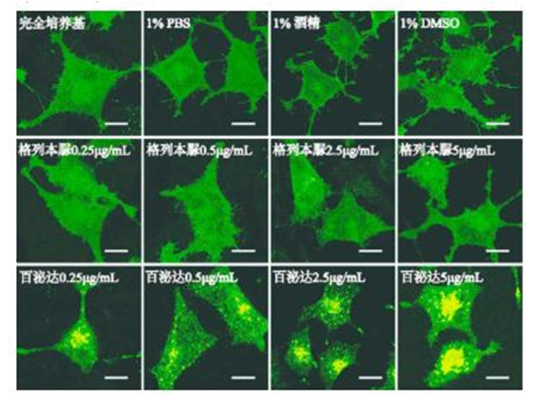
图 5 不同浓度药物处理细胞 1 h 结果(scale bar= 10 μm)Fig 5 Cells treated with different concentrations of drugs for 1 h(scalebar= 10 μm)
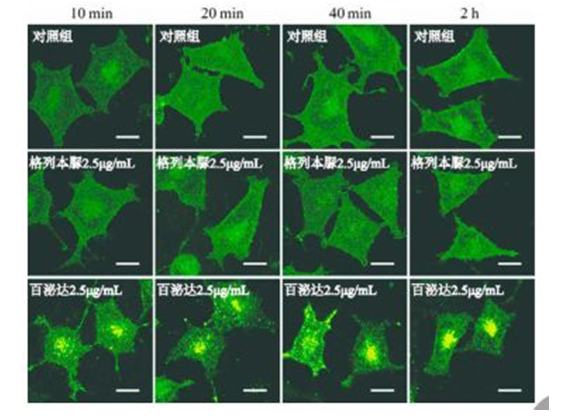
图 6 相同浓度药物处理细胞不同时间结果(scale bar= 10 μm)
Fig 6 Confocal fluorescence microscopy of cells(scale bar= 10 μm)
结果表明:绿色荧光标记的 GLPlR已经成功整合到 Rin-m5F中,并稳定表达。非 GLPlR靶点药物格列本脲处理组细胞内无明显荧光斑点,未能激活模型;GLPlR激动剂药物百泌达处理组细胞内绿色荧光明显聚集成荧光斑点,激活模型。因此该模型建立成功,能用于筛选 GLPlR激动剂类药物。
4、讨论
目前大部分以 GLPlR为靶点构建的高通量激动剂筛选模型的设计原理是根据 GLPlR信号途径的特点来设计,主要可以分为以下 3 个方面[15] :① 基于受体与配体结合原理构建模型:荧光微体积测定技术、荧光偏振法;② 基于检测胞内第二信使 cAMP构建模型:竞争性酶联免疫吸附检测法、闪烁邻近测定法、载黑色素细胞测定法;③ 基于受体功能反应构建报告基因构建模型:陈家琪等[16]在 CHO细胞中稳定转染带有增强型789中南药学 2017 年 6 月 第 15 卷 第6 期 Central South Pharmacy. June 2017, Vol. 15 No.6绿色荧光蛋白(EGFP)报告基因和 GLP1R,殷菲等[17]利用 GLPlR和报告基因在 PC12 细胞中建立稳定的GLPlR激动剂筛选模型。这 3 个方面设计的筛选模型各有特色,受体——配体结合分析检测方法缺点是成本高且不能识别是配体是激动还是拮抗剂;检测 cAMP的筛选模型要求裂解细胞释放出胞内的 cAMP,且还需洗涤除去未结合的标记 cAMP;报告基因筛选模型常需要作用底物或者辅助因子,筛选成本高。本实验中选用 Rin-m5F作为宿主细胞是基于GLPlR 激动剂类药物治疗糖尿病的主要作用靶点位于胰岛细胞上,这样笔者的筛选模型能更加贴切反应药物治疗糖尿病时的生理机能。采用直接标记 GLPlR C端,使靶蛋白可视化,通过观察胞内荧光变化就能直观反应受体被激活,具有极大降低假阳性的优势。高内涵筛选平台是近年发展起来的新的筛选模式,通过采集荧光图像,综合运用高分辨率的荧光数码影像技术、数理统计分析方法等模板在单一实验中反应被测样品的生物活性、药代动力学性质和潜在毒性等。该筛选技术的优势在于所有的检测能在活细胞内进行,筛选速度快。本文建立的基于荧光标记使靶向蛋白可视化的原理,使该模型符合高内涵筛选平台的基本要求,为筛选 GLPlR 激动剂的高通量筛选奠定了坚实的基础。该模型能应用于混合物样品 GLP1 类似物小分子药物的筛选,具有假阳性极低、筛选所需样本小、筛选样品量大、易标准化、筛选速度快、特异性强等优势。同时这种研究模式为我国中药分子机制提供新的思路,为我国中药实现复方创新、早期评价、早期淘汰等目标提供便捷。参考文献[1] 中华医学会糖尿病学分会 . 中国 2 型糖尿病防治指南(2007 年版)[J]. 中华医学杂志,2008,88(18):1227-1245.[2] LiuD,Darville M,Eizirik DL. Double-stranded ribonu-cleic acid(RNA)induces beta-cell Fas messenger RNAexpression and increases cytokine-induced beta-cell apopto-sis [J]. Endocrinology,2001,142(6):2593-2599.[3] Liu D,Pavlovic D,Chen MC,et al. Cytokines induceapoptosis in beta-cells isolated from mice lacking the induc-ible isoform of nitric oxide synthase(iNOS-/-)[J]. Diabe-tes,2000,49(7):1116-1122.[4] Muoio DM,Newgard CB. Mechanisms of disease:Mo-lecular and metabolic mechanisms of insulin resistance andbeta-cell failure in type 2 diabetes [J]. Nat Rev Mol CellBiol,2008,9(3):193-205.[5] 钱荣立 . 关于糖尿病的新诊断标准与分型[J]. 中国糖尿病杂志,2000,8(1):5-6.[6] 姚君厘,杨永年 . 糖尿病并发症感染及其危险因素分析[J]. 中华医院感染学杂志,1998,8(4):216-218.[7] Bahtiyar G,Gutterman D,Lebovitz H. Heart failure:amajor cardiovascular complication of diabetes mellitus [J].Current Diabetes Reports,2016,16(11):116-130.[8] Bril F,Cusi K. Nonalcoholic fatty liver disease:The newcomplication of type 2 diabetes mellitus [J]. Endocrinol Me-tab Clin North Am,2016,45(4):765-781.[9] Bo AE. Islet G protein-coupled receptors as potential targetsfor treatment of type 2 diabetes [J]. Nature Reviews DrugDiscovery,2009,8(5):369-385.[10] 闫荣,杨子义 . 胰高血糖素样肽 -1 类似物新药的研发进展[J]. 中国生物制品学杂志,2011,24(7):866-868.[11] 毛黎静,安春红,张贝娜,等 . 新型糖尿病治疗药物的研究进展[J]. 中南药学,2017,15(1):88-91.[12] 盛灵通,孔建龙,秦健,等 . GLP-1 及其类似物治疗糖尿病的研究进展[J]. 糖尿病新世界,2015,(2):22-23.[13] Lai X,Kang X,Zeng L,et al. The protective effectsand genetic pathways of thorn grape seeds oil against highglucose-induced apoptosis in pancreatic β -cells [J]. BMCComplem Altern M,2014,14(1):10-17.[14] Wu Y,Wang X,Guo H,et al. Synthesis and screeningof 3-MA derivatives for autophagy inhibitors. [J]. Autopha-gy,2013,9(4):595-603.[15] 许芳芳,王楠,李刚强,等 . 人胰高血糖素样肽 -1 的研究与应用进展[J]. 生物技术通报,2016,32(6):30-37.[16] 陈家琪,高智慧,朱元元,等 . 重组胰高血糖素样肽 -1与人血清白蛋白融合蛋白的纯及活性研究[J]. 微生物学通报,2007,34(5):871-874.[17] 殷菲,邓小红,景佳佳,等 . 胰高血糖素样肽 1 受体激动的高通量筛选及作用机制研究[J]. 中国药学杂志,2007,42(1):24-27.
(收稿日期:2017-02-20;修回日期:2017-05-01)
编辑:邹沛霖
免责声明
① 本网所刊登文章均来自网络转载;文章观点不代表本网立场,其真实性由作者或稿源方负责
② 如果您对稿件和图片等有版权及其他争议,请及时与我们联系,我们将核实情况后进行相关删除
③ 联系邮箱:dzshbw@163.com联系电话:01057394474





